本期我们将系统解析CRISPR/Cas系统的编辑效率验证技术,帮助大家完成基因编辑实验的最后确认!
基因编辑效率,简单来说,就是成功实现目标基因编辑的细胞或样本占总细胞或样本的比例。这个比例直接反映了基因编辑工具的有效性,无论是用于科研探索,还是朝着基因治疗、生物制药等实际应用迈进,精准验证基因编辑效率都是必不可少的步骤。
T7核酸酶I
目前市面上最基础的基因编辑检测工具——T7核酸酶I(T7 Endonuclease I),它就像一位敏锐的“侦察兵”,作为核酸内切酶能够特异性的识别并切割不完全配对的DNA序列(non-perfectly matched DNA)。常用于ZFNs、TALENs、CRISPR/Cas9等导致的基因突变的鉴定。如果通过基因编辑技术成功获得了插入或缺失的突变基因序列,那么当基因编辑后的DNA与野生型DNA放在一起时,将其变性再退火复性,野生型的DNA单链和基因编辑后的DNA 单链会错配形成异源双链DNA结构。此时,加上T7核酸内切酶I就可以特异性的识别错配的异源双链DNA并在错配位点附近进行切割。通过琼脂糖凝胶电泳即可显示酶切后的条带,确认基因编辑效率的有效性。
近岸蛋白的T7 Endonuclease I(Cat.No.:M017)能有效检测ZFNs、TALENs、CRISPR/Cas9等基因编辑之后形成的突变体,识别切割效率高,是基因编辑检测的不二之选!
产品用途
-
基因突变和SNP的检测,可应用于TALEN、CRISPR/Cas9基因编辑形成的突变体检测; -
识别错配DNA,分解四方向交叉DNA或分支DNA; -
检测或切割异源二聚体DNA和切割DNA; -
随机切割线性DNA进行shot-gun克隆。
产品性能
01 突变体检测效果好
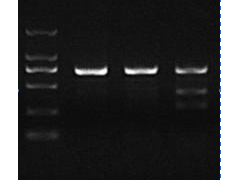
图例)T7EI法检测突变体。泳道1:野生型条带700bp; 泳道2:突变型条带700bp; 泳道3:野生型条带与突变型条带退火,产生T7EI切割条带300bp+400bp。
02 有效切割电转后的突变体
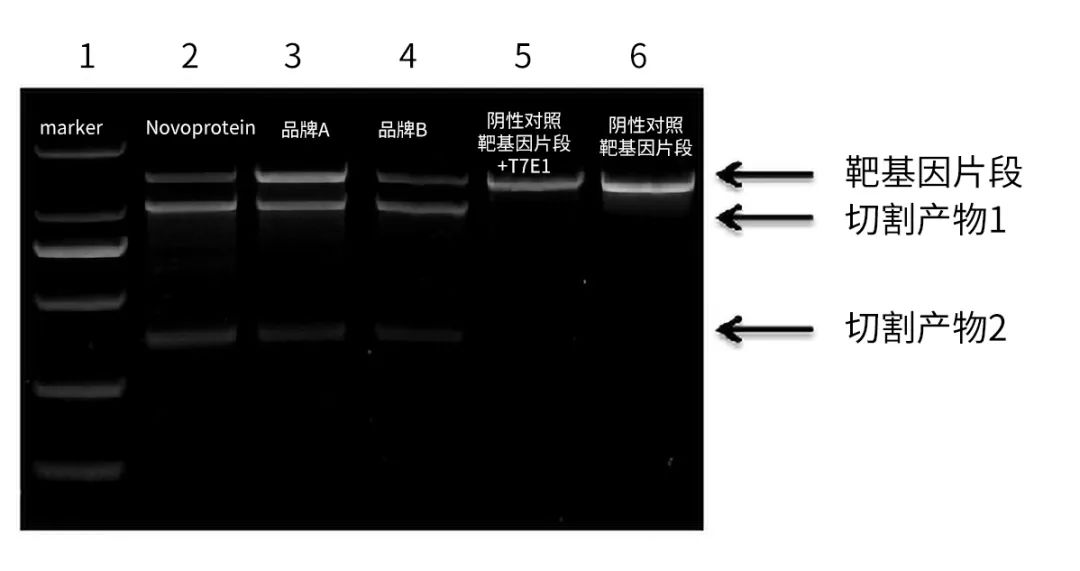
图例)将不同Cas9/sgRNA RNP复合物通过电转方式递送至293T细胞,48h后收集细胞,抽提基因组DNA。使用T7EI(Cat#M017)检测,结果表明相同条件下,近岸蛋白的Cas9蛋白切割效率要优于其他同类品牌。同时证明T7EI有效检测基因编辑效率。
操作步骤
1.取转染后的细胞培养48~72h;
2.收集细胞,提取细胞的基因组(突变体DNA);
3.使用高保真PCR(2×Fast Pfu Master Mix (Quick Load),Cat.No.: E035)分别以突变体DNA和野生型DNA为模板,扩增靶基因编辑的区域;
注:突变位点避免位于片段中间,便于区分切割后的条带
4.变性退火PCR产物
-
反应体系
组分 投入量 10×T7 Endonuclease I Reaction Buffer 1μl PCR产物(野生型:突变型=1:1) 0.3μg RNase Free Water Up to 9.5μl -
反应条件
温度 时间 95℃ 5min 95℃-85℃ -2℃/sec 85℃-25℃ -0.1℃/sec 16℃ 2min -
T7EI酶切反应
当PCR结束后,在PCR产物中加入0.5μl T7EI酶,37℃保温15-30min,立即加入DNA loading buffer终止反应,混匀后65℃保温10min,琼脂糖凝胶电泳检测酶切结果。
基因编辑检测相关产品推荐
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
PCR一代测序法(Sanger法)
在基因编辑过程中会在靶基因引入插入或缺失,直接提取基因组DNA,扩增靶基因附近片段,通过PCR一代测序法鉴定,如果被编辑后的位点检测到双峰或者杂峰,则表示产生了有效的基因编辑。
NGS高通量深度测序法
近岸蛋白有适配NGS测序的多种通用型接头可供选择:
|
|
|
|
|
|
|
NovoNGS® DNA Adapters Set1–Set2 for Illumina® |
|
|
|
|
|
|
|
质谱分析法
质谱分析法的核心在于测定生物分子质荷比来分析其结构。在基因编辑检测时,先将基因编辑后的细胞或组织样本提取蛋白质,经纯化、酶解处理成肽段混合物。通过电喷雾离子化(ESI)或基质辅助激光解吸离子化(MALDI)等方式,使肽段转化为气态离子。离子束进入质量分析器,在电场和磁场作用下,不同质荷比的离子发生分离,例如在飞行时间质量分析器中,离子依飞行时间差异确定质荷比。最后得到质谱图,将其与数据库中已知蛋白质质谱图比对,分析肽段质荷比、相对丰度等信息,推断蛋白质氨基酸序列。由于基因编辑会改变蛋白质编码序列和一级结构,通过对比质谱图变化,可间接反映基因编辑对蛋白质的影响,评估基因编辑效果 。
流式细胞术
流式细胞术是基于细胞光学特性与荧光标记的检测技术。当基因编辑后的细胞样本制成单细胞悬液后,在压力驱动下,细胞依次通过流动室与激光束相交。细胞受激光激发产生荧光,同时会产生散射光,前向散射光与细胞大小相关,侧向散射光与细胞内部结构复杂度有关 。如果基因编辑使细胞表达特定标记蛋白,标记特异性抗体与目标蛋白结合后,细胞携带荧光信号。光学系统收集这些荧光和散射光信号,荧光检测器(光电倍增管)和散射光检测器(光电二极管)将光信号转化为电信号。通过对这些信号的分析,如绘制荧光强度与细胞数量的直方图等,能够计算出基因编辑成功表达目标蛋白的细胞比例,实现对细胞群体的多参数、定量分析 。
下一期,我们将聚焦基因编辑实验操作过程中脱靶问题的解决方案,从优化编辑工具到调整实验条件,手把手教你提高基因编辑实验的成功率!记得持续关注,一起在基因编辑的道路上披荆斩棘!
近岸蛋白能提供基因编辑系列产品的全套解决方案,各位小伙伴可以联系官方后台申请试用~
CRISPR/Cas系统相关产品推荐表
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
