6月22日,国家药监局官网显示,复星凯特靶向CD19 CAR-T阿基伦塞注射液获批上市,这是国内第一款获批上市的细胞疗法。根据复星凯特此前公告,该上市申请适应症为:用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤(DLBCL)非特指型,原发性纵隔B细胞淋巴流(PMBCL),高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。


阿基仑赛注射液是复星凯特从吉利德子公司Kite制药引进的靶向CD19自体CAR-T细胞治疗产品Yescarta,拥有其在中国包括香港、澳门的商业化权利,并于中国境内(不包括港澳台)进行本地化生产。

此前,该疗法已在2017年10月获美国FDA批准上市,成为全球第一款用于治疗复发/难治性大B细胞淋巴瘤的CAR-T细胞药物。随后2018年8月,Yescarta在欧盟获批上市。2021年3月,Yescarta获FDA加速批准,用于治疗之前接受过二线及以上全身治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。
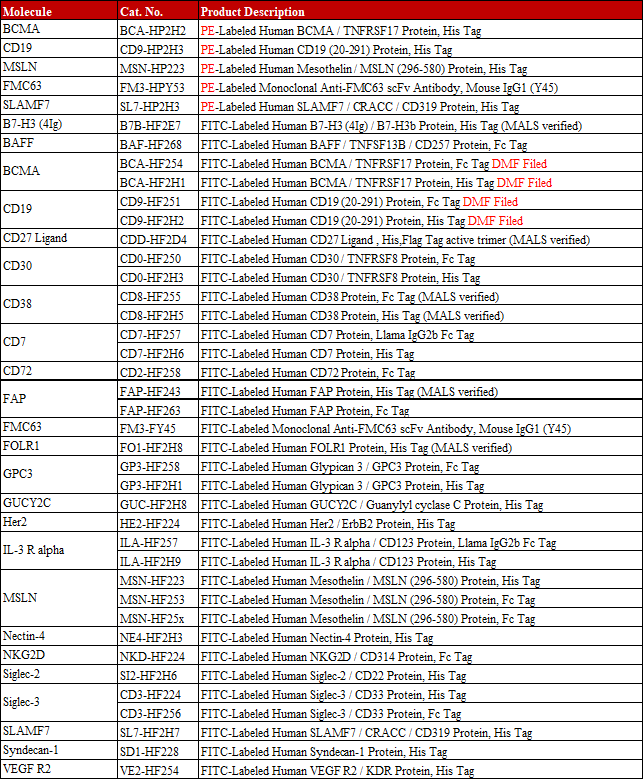
2017年初,复星凯特从Kite公司引进Yescarta,获得全部技术授权,并拥有其在中国包括香港、澳门的商业化权利,并于中国境内(不包括港澳台)进行本地化生产。2020年2月,复星凯特在完成治疗成人复发难治性大B细胞淋巴瘤的中国境内桥接临床试验后,在国内提交了阿基仑赛注射液上市申请,用于治疗治疗成人复发难治性大B细胞淋巴瘤,并于2020年3月被CDE纳入优先审评。目前,全球已有5款CAR-T细胞疗法上市,4款靶向CD19,1款靶向BCMA。
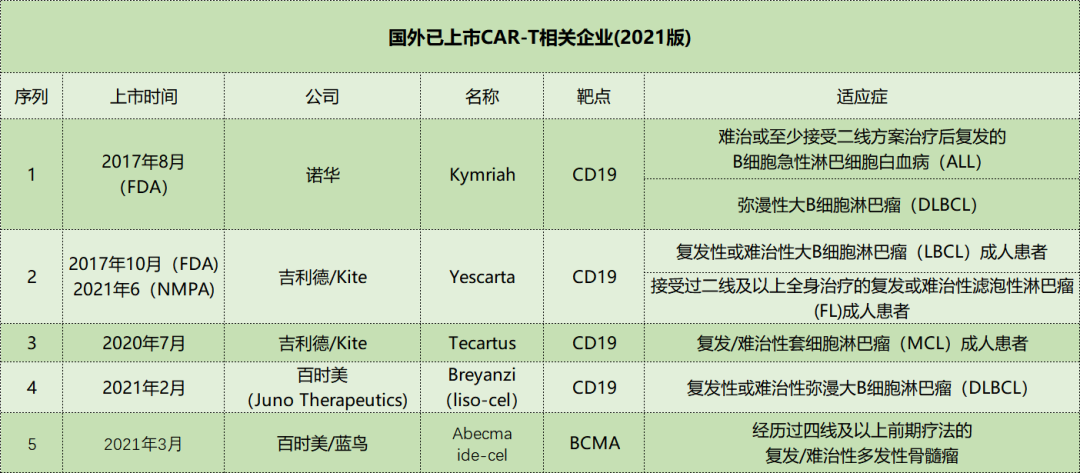
细胞治疗产品的市场销售情况
已上市的5款细胞疗法产品中,适应症大致分为弥漫大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)以及多发性骨髓瘤(MM)。从这几个适应症来看看这些产品近两年的销售情况。
弥漫大B细胞淋巴瘤(DLBCL)
弥漫大B细胞淋巴瘤(DLBCL)是一组大细胞、侵袭性的恶性淋巴瘤,是最常见的非霍奇金淋巴瘤(NHL),约占30-40%,亚洲国家多大于40%,中位发病年龄65岁。在采用目前的标准治疗时,难治性DLBCL的中位总生存期(OS)仅为6个月,只有7%的患者能实现完全缓解。目前,接受二线和多线治疗的DLBCL患者预后很差,近半数的患者在移植后不久失去治疗反应或病情复发。
在美国,每年大约有7500例难治性DLBCL患者有资格接受CAR-T疗法,全球DLBCL治疗药物市场预计将在2022年达到近43亿美元的规模,DLBCL的市场规规模和利润空间正逐年大幅度增长。
-
Kymriah
Kymriah是诺华公司开发的一款靶向CD19抗原的CAR-T产品,2017年批准上市,它除了治疗DLBCL外,首先被批准的适应症是治疗25岁以下复发或难治性前体B细胞急性淋巴细胞白血病(ALL)。
2020年Kymriah销售了4.74亿美元,同比增长68%。定价方面,Kymriah白血病适应症费用为47.5万美元,淋巴瘤适应症费用为37.3万美元。尽管价格昂贵,但2020年即使在疫情的背景下,Kymriah依然实现了4.74亿美元的销售额。2020年增速显著得益于近年来诺华大幅提升了Kymriah的制备效率,分别在美国、瑞士、德国、中国等地加速设厂,而凭借诺华卓越的药物推广能力,Kymriah未来销售额有望超越Yescarta。在诺华2021年的业绩展望中,已将Kymriah视为未来业绩增长的关键推动力。
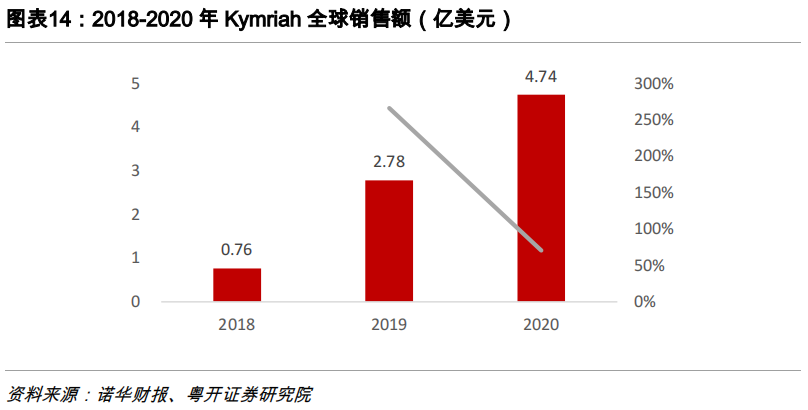
在国内,2018 年,诺华和西比曼生物达成战略合作协议,西比曼生物负责在中国生产和供应Kymriah,诺华公司将成为营销许可的仅有的持有人。2019年10月30日,Kymriah 在中国获批临床,适应症为复发性或难治性侵袭性 B-细胞非霍奇金淋巴瘤,目前处于临床Ⅲ期。
-
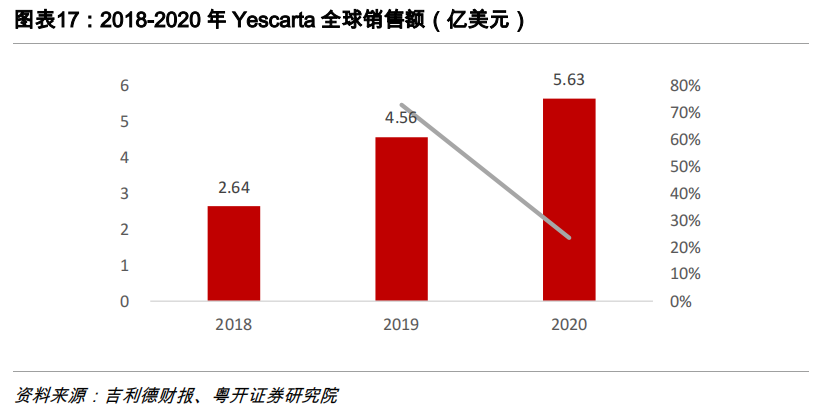
Yescarta
Yescarta(阿基仑赛注射液)是一款由吉利德/Kite研发的靶向CD19的CAR-T细胞疗法,2017年获FDA批准用于既往接受二线或多线系统治疗的复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者的治疗;2021 年 3 月 5 日,Yescarta 获批用于治疗已接受过 2 种或更多种系统治疗方案的复发性或难治性滤泡性淋巴瘤(FL)成人患者。
2017 年8月,吉利德科学以119亿美元收购Kite Pharma,并获得了Kite旗下Yescarta的权益。2020年,Yescarta全球销售额达5.63亿美元,同比增长23%。定价方面,Yescarta在美国市场的定价为37.3万美元,与Kymriah的DLBCL适应症定价相同。2020年,受 Kymriah冲击,Yescarta销售额达5.63亿美元,增速放缓,同比增长23%。值得一提的是,Kite公司CAR-T细胞产品制备优势明显,在ZUMA-2试验中便展示了96%的制造成功率及平均15天的产品交付周期,对于晚期肿瘤患者十分关键,但这一优势随着诺华等公司 CAR-T细胞制备技术的提升正逐步缩小。
目前,复兴凯特已从Kite制药引进该疗法,并在国内获批上市,成为国内第一款上市的细胞疗法,其商业化进程已准备就绪,国内细胞疗法市场即将打开。
-
Breyanzi
Breyanzi(lisocabtagene maraleucel,JCAR017)是百时美旗下一款靶向CD19的CAR-T 产品,2021 年 2 月,美国FDA批准Breyanzi用于弥散性大B细胞淋巴瘤成年患者的治疗(DLBCL)。目前,Breyanzi在美国市场的定价为41.03万美元,介于Kymriah和Yescarta之间。销售数据还未有披露。
不过与Kymriah和Yescarta相比,Breyanzi具有很好的安全性数据,其细胞因子释放综合征(CRS)的发生率只有2%,而Kymriah为23%,Yescarta为13%。
套细胞淋巴瘤(MCL)
套细胞淋巴瘤(MCL)一种罕见的非霍奇金淋巴(NHL),起源于淋巴结“套区”的细胞,中位发病年龄在60岁以上,且多数患者在诊断时已处于病程的III期或IV期。许多患者在治疗期间病情逐步进展。接受过2种或多种系统疗法(包括BTK抑制剂)治疗后的难治性/复发性患者预后很差,中位总生存期仅为6-10个月。目前,FDA仅批准了一款CAR-T产品Tecartus用于治疗MCL。
-
Tecartus
Tecartus(brexucabtagene autoleucel,KTE-X19)是一款由吉利德/Kite Pharma研发靶向CD19的CAR-T细胞疗法。2020年7月获批上市,用于治疗复发或难治性套细胞淋巴瘤(MCL)的成人患者,适应症定价为37.3万美元。获批后,2020年下半年Tecartus的销量为0.44亿美元;2021年第一季度的销量环比下降了8%。
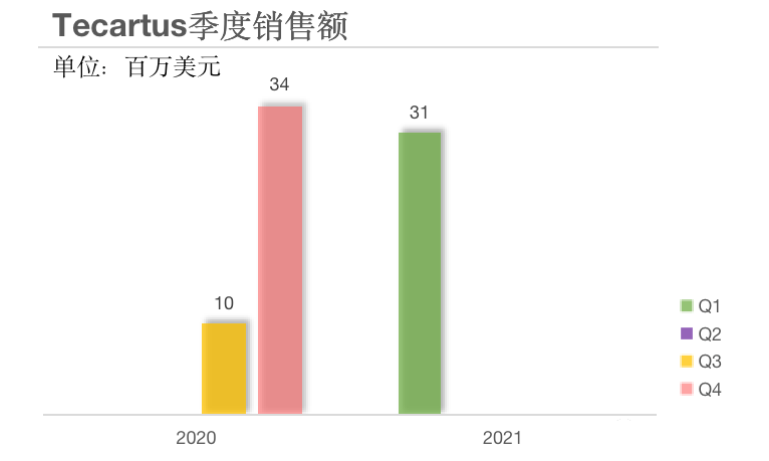
多发性骨髓瘤(MM)
多发性骨髓瘤(MM)是一种浆细胞克隆性恶性增生性疾病。MM为血液系统三大恶性肿瘤之一,好发于中老年,发病率次于淋巴瘤,而高于白血病。其特征是骨髓被恶性浆细胞取代,骨质破坏和异常单克隆免疫球蛋白(即M蛋白)大量生成,并通过多种机制产生骨痛、贫血、肾功能损害等临床症状和体征。
近些年,我国的MM发病率呈逐年增高状态,大多数患者在初始治疗后复发,治疗产生应答的程度、持续时间以及生存结果随着每次连续治疗而降低。暴露于免疫调节剂,蛋白酶体抑制剂和抗CD38抗体三种主要药物类别的复发性或难治性MM患者临床预后较差,应答率仅为20%-30%,反应时间仅有2-4个月,生存率非常低。目前,FDA仅批准了一款CAR-T产品Abecma用于治疗MM。
-
Abecma
Abecma是百时美施贵宝旗下公司Bluebird Bio开发的一款靶向B细胞成熟抗原(BCMA)的CAR-T产品,于2021年3月批准上市。在美国市场定价41.95万美元,销售数据还未有披露。
Abecma是全球第一个BCMA导向CAR-T细胞疗法。BCMA是一种广泛存在于MM细胞表面的B细胞生物标志物,所以Abecma能够很好地识别并结合MM癌细胞,导致表达BCMA蛋白的癌细胞死亡。
推荐阅读:全球第一个靶向BCMA CAR-T细胞疗法获批上市
据悉,2020年,治疗MM药物的全球市场规模约为99亿美元,至2027年,将会达到271亿美元,年均复合增长率可达15.5%。如此巨大的市场里,达雷木(Daratumumab)单抗几乎占据了半壁江山,2020年,达雷木单抗全球销售额41.9亿美元,同比增长39.8%,势头十分强劲。Abecma在市场上可能面临不小的竞争。
商业化竞争拉开帷幕
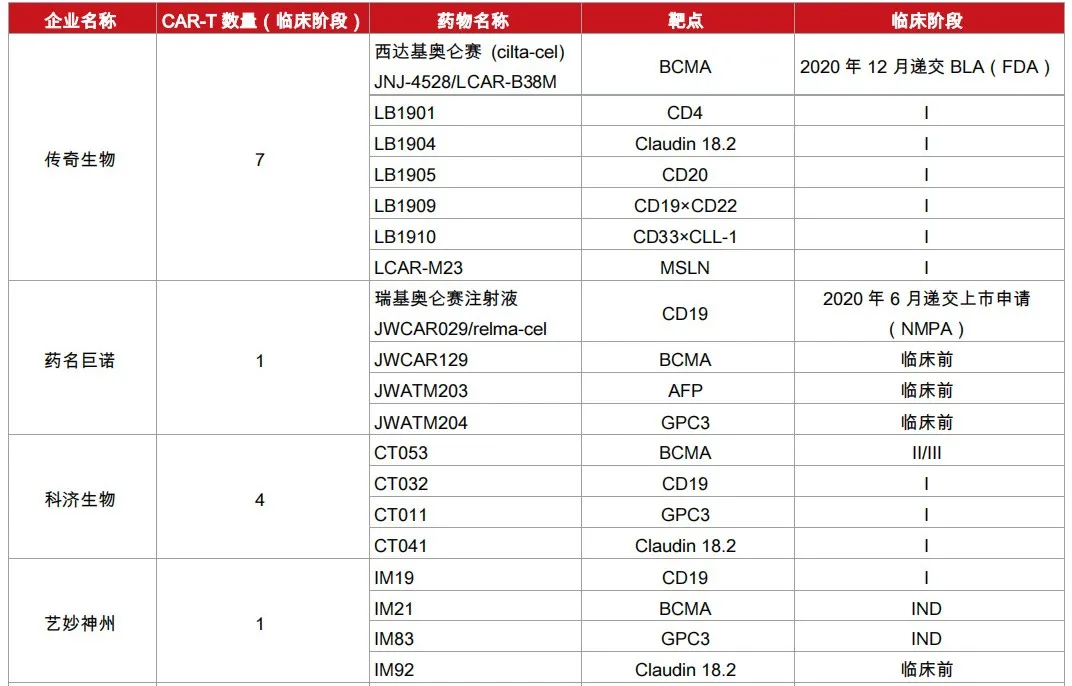
随着国内第一款CAR-T疗法的上市,细胞疗法领域的商业化竞争逐渐拉开帷幕。据悉,2019年12月,复星凯特第一个CAR-T产业化生产基地便在上海张江正式启用,建筑面积约10000平方米,严格按照GMP标准设计、建造和管理,几十条生产线可以同时平行进行CAR-T产品的制备。前不久,港股上市的科济药业也重压CAR-T细胞疗法,公司在2019年也在上海金山建立了CAR-T细胞治疗产品商业化生产基地,建筑面积7600多平方米。除此之外,目前国内已有数十家企业布局CAR-T疗法,进入临床的已有不少,其在靶点选择、CAR-T结构创新、载体选择、针对癌种、中外合作等方面,各企业也别具特色。
恒润达生:共获得 3 个 CAR-T 临床批件,同时布局 U-CART、TCR-T、溶瘤病毒等领域。2019 年 9 月,完成由深创投领投的 2 亿元 B 轮融资。
西比曼:第一个在纳斯达克上市的中国细胞治疗生物科技公司,与诺华达成战略合作协议,在中国生产、供应 CAR-T 细胞治疗药物 Kymriah。此外,其干细胞产品获得2张IND批件。
华道生物:具备 CAR-T 产业化全流程、全产业链国产化能力,自主研发的相关 CAR-T 细胞生产、转运、仓储设备走向量产,极大压缩 CAR-T 细胞生产成本。2019年8月完成新开源领投的B轮1亿元融资。
斯丹赛:独有“装甲型” CAR-T 技术,靶标CD19和PD-1,目前在美国进行的非霍奇金淋巴瘤的临床前研究表明,PD-1的抑制可以增强CAR-T细胞功能,在中国的临床试验中患者达到 92.3% 的客观缓解率。2018年完成1.8亿元B轮融资,投资方包括火山石资本、高特佳投资、软银中国、敦厚资本及智诚资本等。
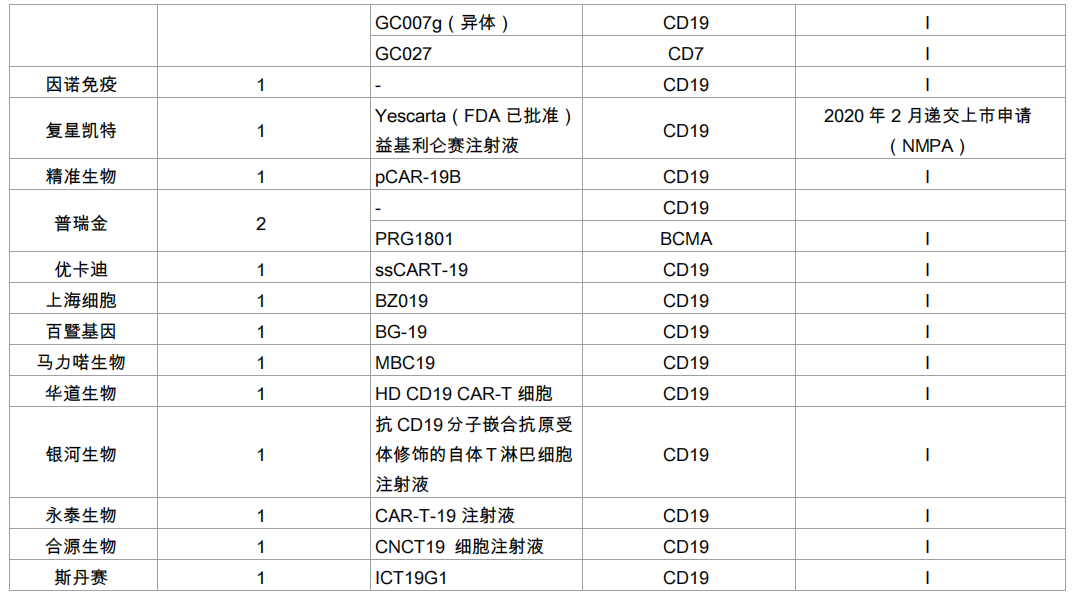
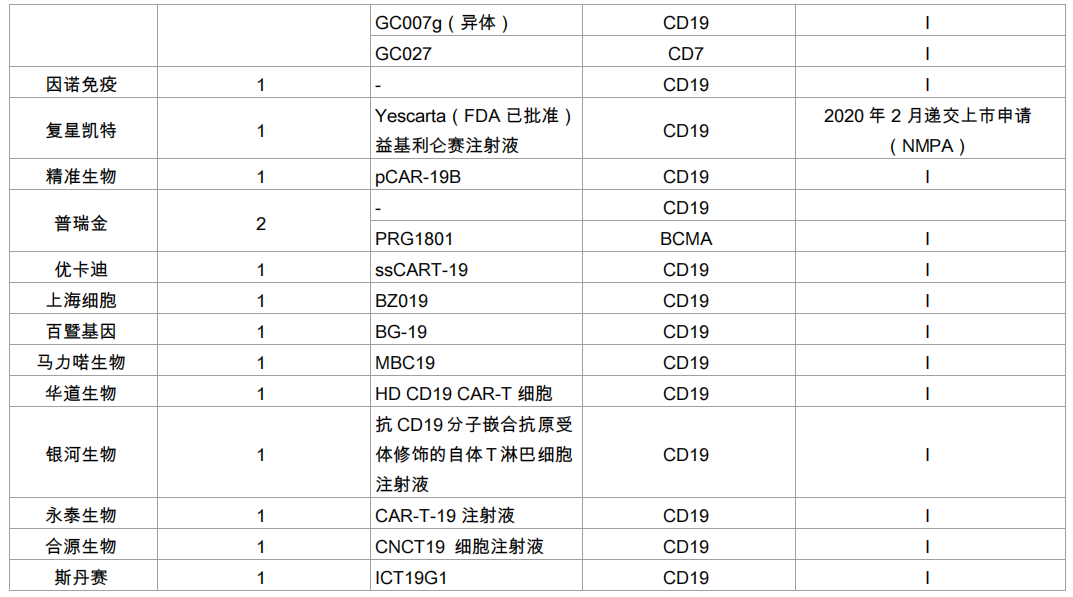
优卡迪:应用二代及三代 CAR-T 技术,同时在 T 细胞上设计了抑制 PD-1 和 PD-L1 的结构元件和示踪清除标记。一共获得5个CAR-T 临床申报受理,为中国企业最多。
吉凯基因:CAR-T技术平台涵盖从一代到四代CAR的构建技术,在研疗法 CD19-CART 已完成将近 30 例血液瘤临床试验,结果显著。公司以科研服务起家,与中国 90% 的研究型医院有长期稳定合作关系,在成果引进及产品上市后的渠道推广方面拥有天然优势。
上海细胞治疗:使用非病毒载体达到与主流病毒载体接近的转染率,目前已申请 176 项细胞治疗相关**。具有国内最大的免疫细胞冻存平台,同时兼具独特转染方式的CAR-T药物研发平台以及肿瘤治疗医院。2018年12月完成9.25亿元C轮融资。
科济生物:开展了全球第一个针对肝细胞癌的 CAR-T 细胞临床试验。产品 CT053 被 EMA 纳入优先药物计划,被 FDA 授予再生医学先进疗法资格。目前其金山区厂房正式落成,成为国内第一个进入商业化生产且符合GMP标准的CAR-T厂房。
亘喜生物:产品 GC007 注射液获得国内第一个异体 CAR-T 产品IND批件。独有 FasTCAR 技术,可将 CAR-T 制备周期从传统的两周缩短至一天,此外还布局了通用型 CAR-T 以及双靶点 CAR-T。2019 年 2 月,完成由淡马锡领投的 8500 万美元 B 轮融资。
传奇生物:以BCMA 为第一个研发突破的靶点。2018年3月,其用于治疗多发性骨髓瘤的LCAR-B38M细胞制剂获CDE批准,成为国内第一个获批临床的 CAR-T产品,其JNJ-4528细胞制剂被FDA授予突破性疗法认定。
博生吉:具有完备的全自动、全密闭 CAR-T 细胞生产线,目前已建立了符合GMP要求的超2000平米CAR-T细胞生产车间、较为完善的质量控制体系及治疗控制设施和设备,可满足CAR-T细胞产品的临床试验要求。
艺妙神州:通过实现其独有的无血清悬浮慢病毒工艺及长效 T 细胞富集工艺,显著提高 CAR-T 细胞的疗效和安全性,降低制备成本。2019年1月完成1.4亿元人民币C轮融资。近日,其IM19细胞药物获IND批件。
驯鹿医疗:拥有独特的全人源抗体库和淘选鉴定技术平台、稳定的质粒病毒规模化生产技术平台和细胞产品全流程的 CMC 能力。在实体瘤治疗领域布局 TCR-like CAR-T 细胞治疗产品,可用于治疗胃癌、鼻咽癌等实体瘤癌症。今年3月,完成高瓴创投领投的6000万美元B轮融资。
合源生物:2019年6月,美国纳斯达克上市公司英创远达与其正式签署许可协议,获得其CNCT19项目全球独有商业权益。2019 年 7 月,完成由英创远达领投的亿元级 A+ 轮融资。目前建有1400平米GMP免疫细胞治疗药物研发和转化基地,另有7000平米GMP免疫细胞药物生产基地在建设中。
北恒生物:核心团队来自 CAR-T 细胞疗法创始人之一 Carl June 教授团队,从新型共刺激结构域设计、改善肿瘤微环境抑制作用、腺相关病毒等多方面对 CAR-T 疗法进行升级改造。2019年2月完成由德诚资本投资的约1亿元A轮融资。
博雅辑因:致力于将基因组编辑技术转化为癌症治疗的创新疗法,并开发即诊即用的通用型 CAR-T 技术。2019 年 9 月,完成了由 IDG 资本和礼来亚洲基金投资的近亿元 Pre-B2 轮融资。
普瑞金:具备 CDMO 能力,提供 CAR-T 药物一站式整体解决方案,在产业化平台的加持下实现 CAR-T 从科研成果到成药的转变。
波睿达:拥有全球第一个“应用 CAR-T免疫细胞治疗 HIV”发明**,并在全球范围内率先开展了人体临床研究试验,相关产品能直接杀死 HIV 病毒感染的细胞,并能与病毒激活剂药物联用清除 “鸡尾酒疗法”中的遗漏细胞,实现 HIV 感染的 CAR-T 细胞精准治疗。日前,其靶向CD30的CAR-T产品(BRD-01)获批临床。
精准生物:研究范围涵盖 CAR-T、TCR-T、CAR-NK、干细胞治疗与基因编辑、基因治疗技术,同时布局异体 CAR-T 细胞、微环境诱导型 CAR-T 细胞等领域的研发。
华夏英泰:具有丰富的 CAR-T 和 TCR-T 技术研发管线,适应症包括血液肿瘤、实体肿瘤以及病毒感染相关等疾病。
邦耀生物:全球第一个将 CRISPR/Cas9 应用于哺乳动物,已有针对多发性骨髓瘤及前列腺癌治疗的通用型 CAR-T。
参考来源:
1.粤开医药:CAR-T 深度报告(一):CAR-T概念及全球上市CAR-T疗法
2.药时空:CAR-T发展的演变
产品列表
流式验证数据
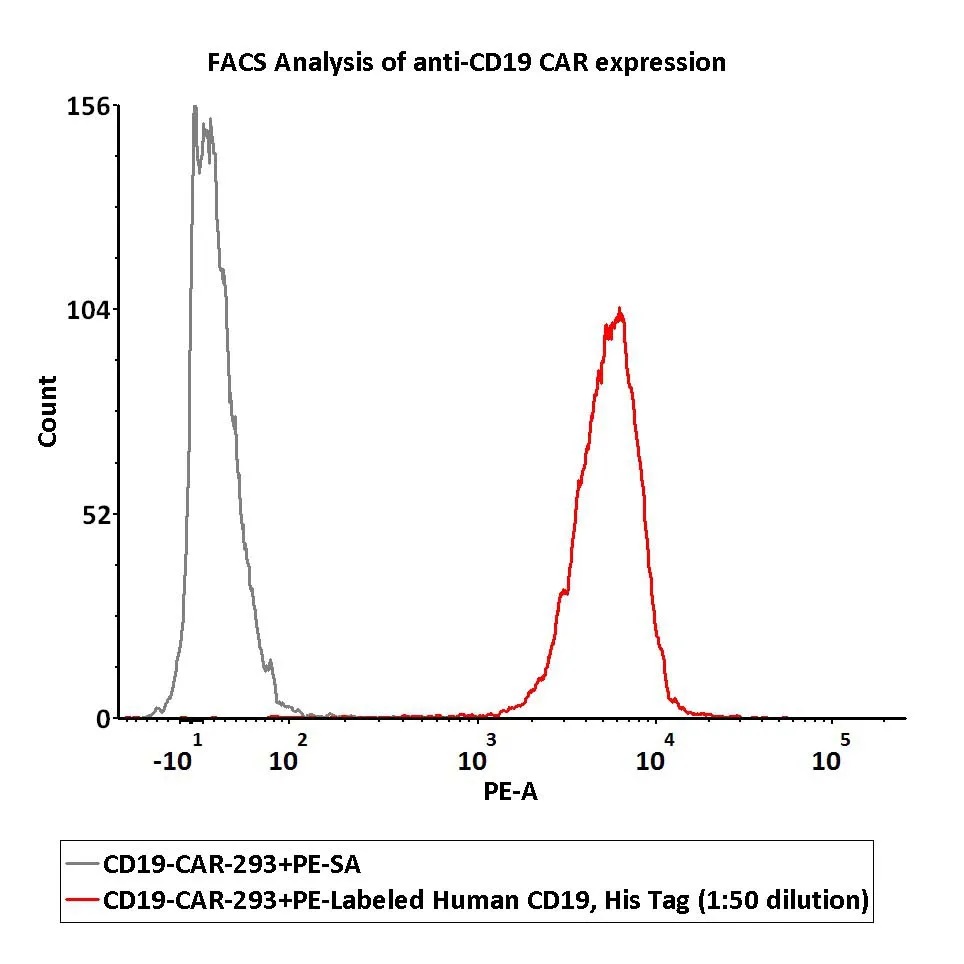
1e6 of the anti-CD19 CAR-293 cells were stained with 100 μL of 1:50 dilution (2 μL stock solution in 100 μL FACS buffer) of PE-Labeled Human CD19 (20-291), His Tag (Cat. No.CD9-HP2H3). PE Streptavidin was used as negative control (QC tested).
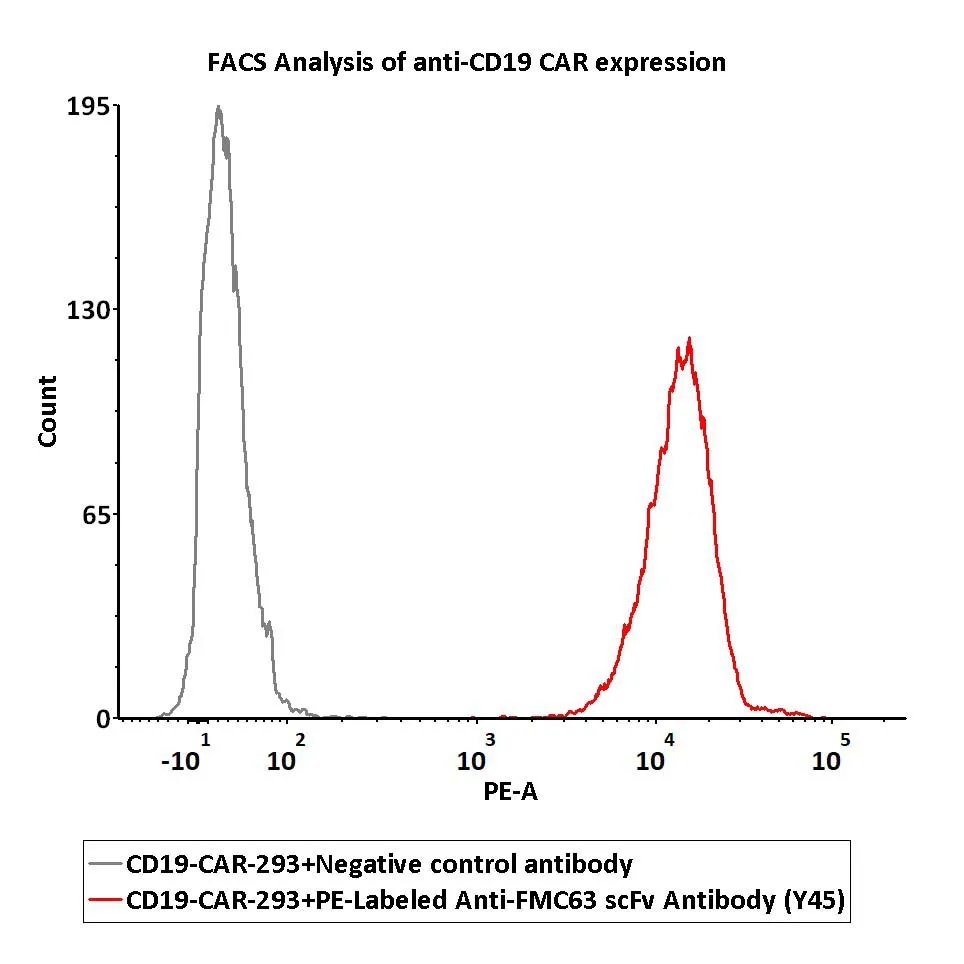
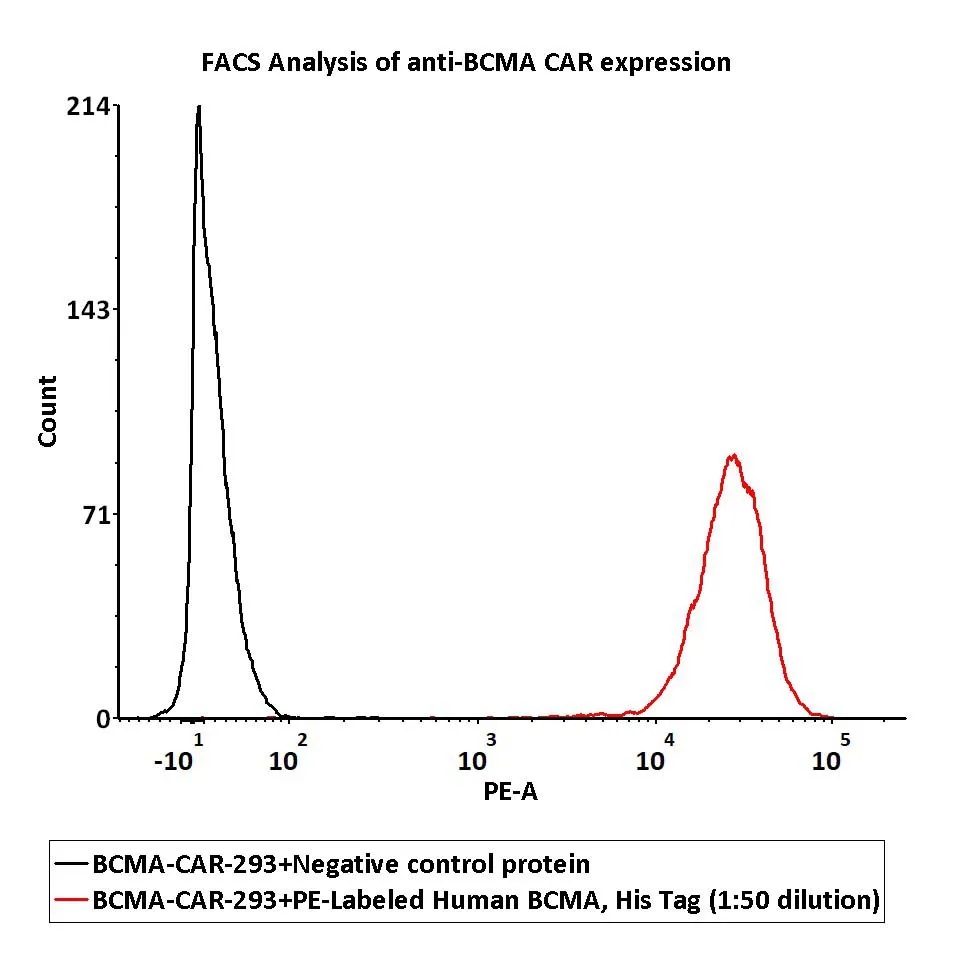
ACRO细胞治疗资源分享群聚焦细胞治疗领域新靶点、新技术、新疗法等相关主题的讨论,热点文章分享和解读,也希望大家能够更多的参与进来,讨论各类问题!
现申请入群还可获取国内外关于细胞治疗的指导原则和政策文件,快来申请吧~

马上扫码入群,了解疫苗领域热点吧~

(备注:姓名+公司)

您可通过以下方式联系到ACROBiosystems:
邮件:inquiry@acrobiosystems.com
电话:15117918562
(备注:姓名+公司)