iPSC(Induced Pluripotent Stem Cells,诱导多能干细胞)是通过将成人体细胞(如皮肤或血液细胞)转化为具有多能性的干细胞,进而具备分化成所有体细胞类型的能力。这一技术最初由日本科学家山中伸弥于2006年成功开发,标志着干细胞研究的一个重大突破[1]。iPSC 类似于胚胎干细胞,可以分化为人体的所有细胞类型,包括心脏、神经、肌肉、肝脏等多种细胞类型[2]。与胚胎干细胞不同,iPSC可以通过基因重编程技术从体细胞中获得,因此不涉及胚胎伦理风险。
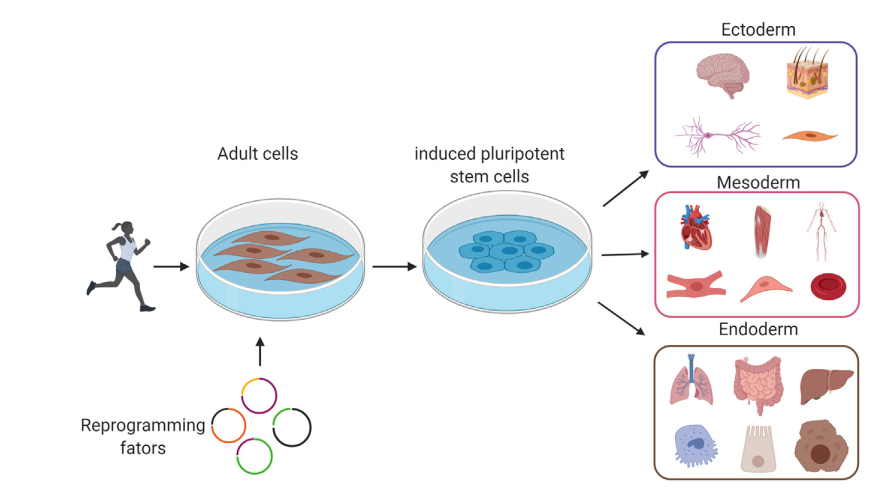
图1. 来自患者或健康个体的成体细胞重编程成诱导性多能干细胞
iPSC正在改写这些疾病治疗
器官修复与替代
iPSC来源的心肌细胞,因其能够精准再生受损的心脏组织,已经成为心脏病治疗领域的一项重要创新。这些iPSC来源的心肌细胞可以通过分化成心肌样细胞,帮助修复由于心脏病(如心肌梗死、缺血性心脏病等)引起的心脏损伤,改善心脏功能和血流动力学。2025年1月,国际学术期刊 Nature 报道了南京鼓楼医院王东进团队的一项临床治疗研究,在这项研究中,两名中国男子接受了基于“重编程”干细胞的实验性心脏病治疗,并在一年后成功康复[3]。
与此同时,iPSC来源的视网膜细胞为视网膜退行性疾病(如年龄相关性黄斑变性、视网膜色素变性等)的治疗提供了新的希望。这些疾病通常导致视网膜细胞的丧失或功能衰退,最终造成视力丧失。通过将iPSC细胞定向分化为视网膜色素上皮细胞或视网膜神经节细胞,研究人员能够重建受损的视网膜组织,从而恢复视网膜的正常功能[4]。2024年11月7日,大阪大学的研究人员在国际医学期刊《柳叶刀》(The Lancet)上发表了题为:Induced pluripotent stem-cell-derived corneal epithelium for transplant surgery: a single-arm, open-label, first-in-human interventional study in Japan 的研究论文[5]。该临床研究使用人诱导多能干细胞(iPSC)来源的角膜上皮细胞片(iCEPS)修复角膜缘干细胞缺乏症(LSCD)视力障碍患者角膜。
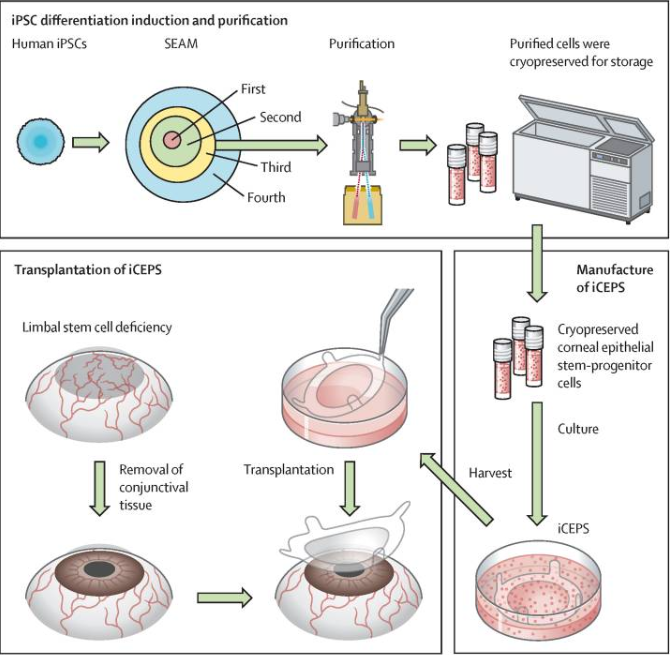
图2. iPSC分化为角膜上皮祖细胞(iCEPS)并移植到视力障碍患者角膜中全过程示意图
iPSC技术在神经退行性疾病的治疗中也显现了显著的应用潜力,尤其是在阿尔茨海默病(AD)和帕金森病(PD)的研究中。神经退行性疾病通常伴随神经细胞的损伤和死亡,导致认知功能和运动功能的下降。从患者体内采集体细胞,重新编程为iPSC,并进一步分化为特定类型的神经细胞(如多巴胺能神经元),为治疗神经退行性疾病提供了新的思路[6]。2018年,日本京都大学研究团队宣布启动利用iPSC治疗帕金森病的临床试验,用iPSC分化成多巴胺神经前体细胞并将其移植到帕金森病患者脑部,以此验证该细胞对于治疗帕金森病的安全性和有效性。
组织工程与器官移植
通过将iPSC分化成特定的细胞类型,结合生物工程技术,将细胞植入三维支架中,再加上外部微环境的调控,可以模拟器官的原生结构和功能,此技术成为再生医学中的重要突破。例如,皮肤的再生治疗。通过将iPSC分化为表皮细胞、角质形成细胞等皮肤相关细胞,结合支架材料,研究人员能够创建人工皮肤,供烧伤患者、创伤患者等使用[7];此外,iPSC衍生的肾脏类器官、肝脏类器官、心脏类器官等已经在研究中取得了初步的进展,为器官移植提供了全新的思路和方法[8]。未来,随着技术的发展,iPSC来源的器官构建有望成为解决器官捐赠短缺和提高移植成功率的重要手段。
iPSC疗法在再生医学领域已取得显著进展,持续推动行业发展需要产业链上下游共同努力。近岸蛋白深耕重组蛋白领域多年,致力于提供高品质蛋白和蛋白工具助力更多iPSC细胞治疗药物的成功开发。近岸蛋白可提供高活性,高批间一致性的系列GMP级细胞因子,在iPSC大规模培养以及定向分化中具有关键作用;同时提供高编辑效率、低脱靶以及专利授权清晰的GMP级基因编辑器,帮助克服iPSC疗法在免疫排斥及致瘤性方面的挑战。
产品数据
高活性iPSC培养基质蛋白
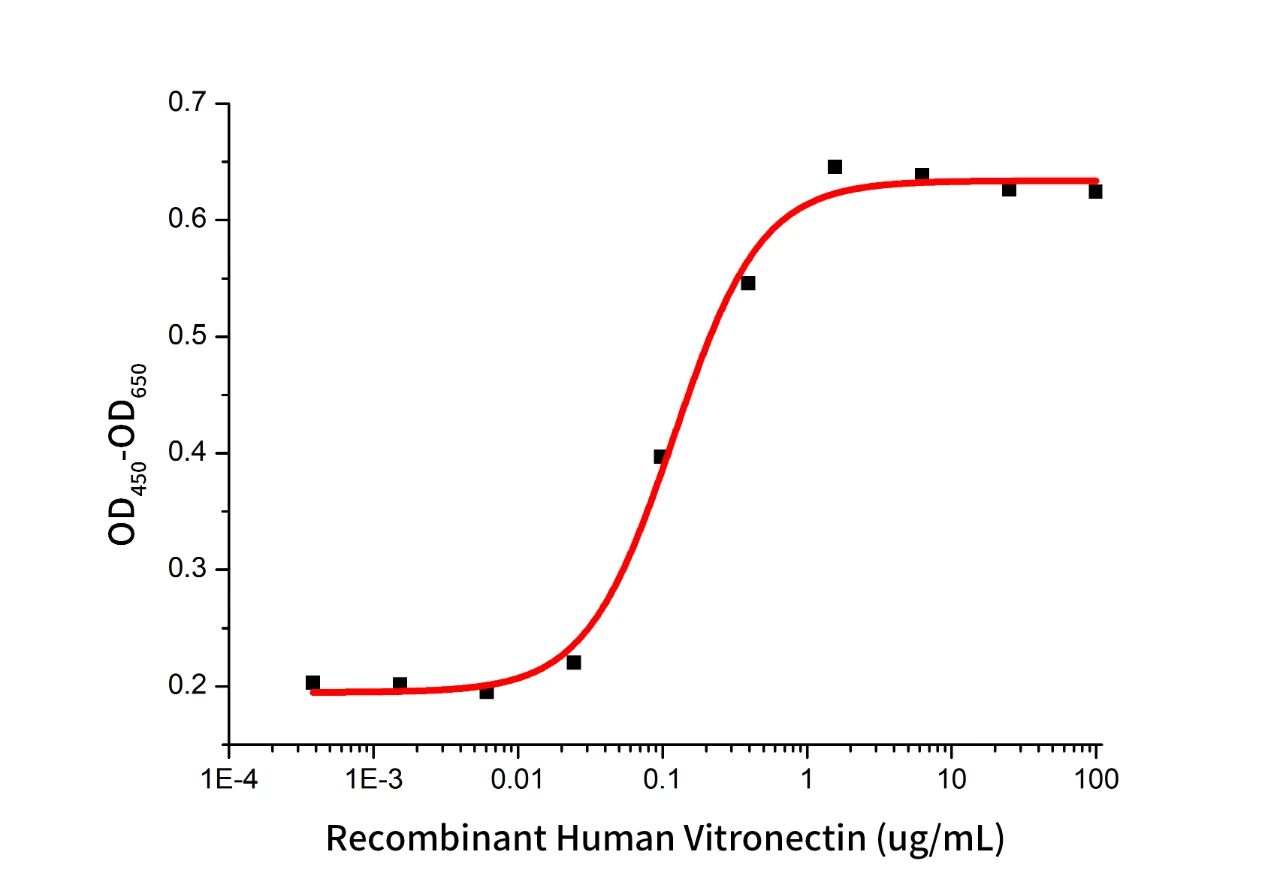
Recombinant Human Vitronectin (Cat.No.:GMP-C395)
Measured by its ability to support iPS cell attachment and spreading when used as a substratum for cell culture. The ED50 for this effect is 0.12ug/mL
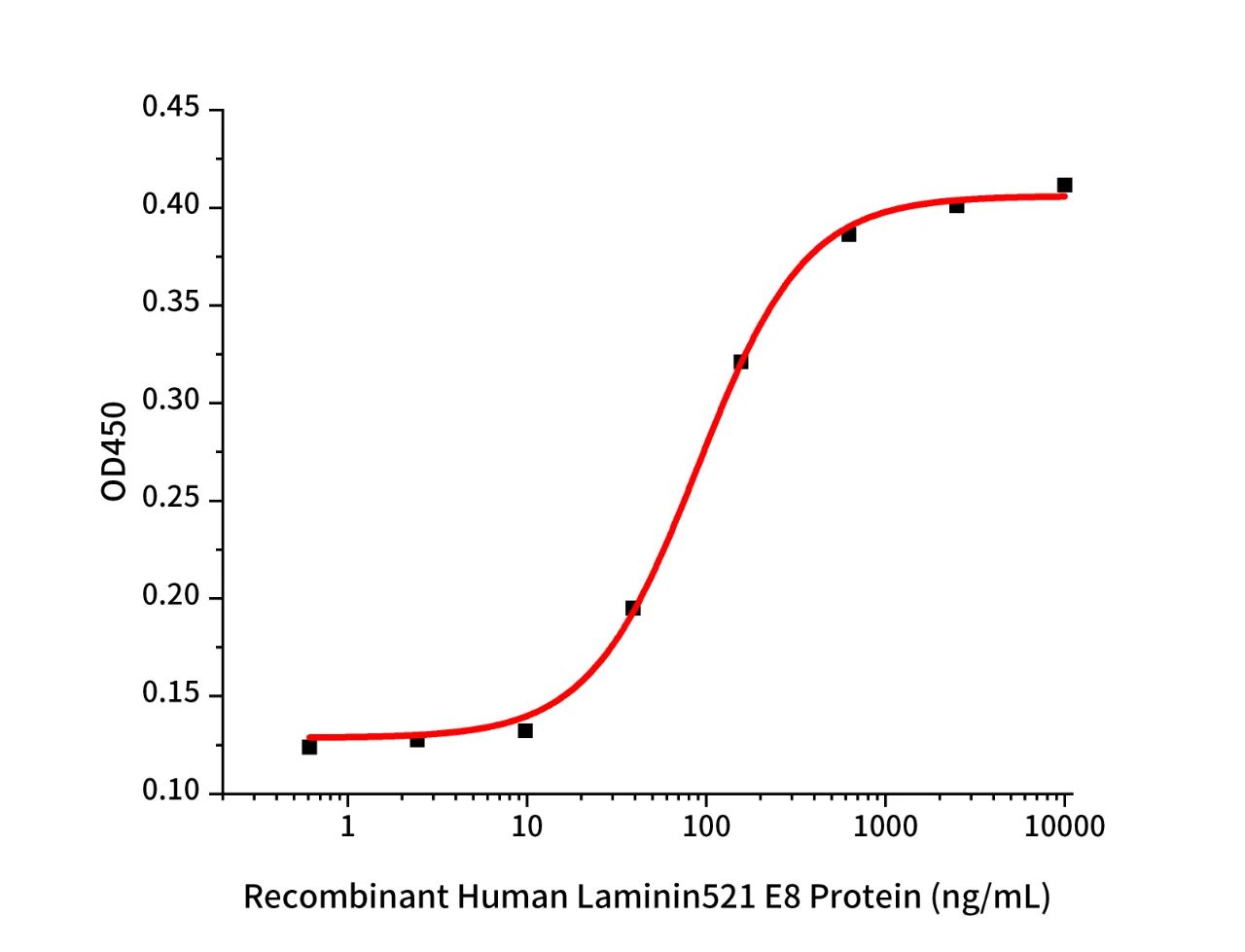
Recombinant Human Laminin 521 E8 (Cat.No.:GMP-C28D)
Measured by its ability to support iPS cell attachment and spreading when used as a substratum for cell culture. The ED50 for this effect is 89 ng/mL.
高活性iPSC诱导分化细胞因子
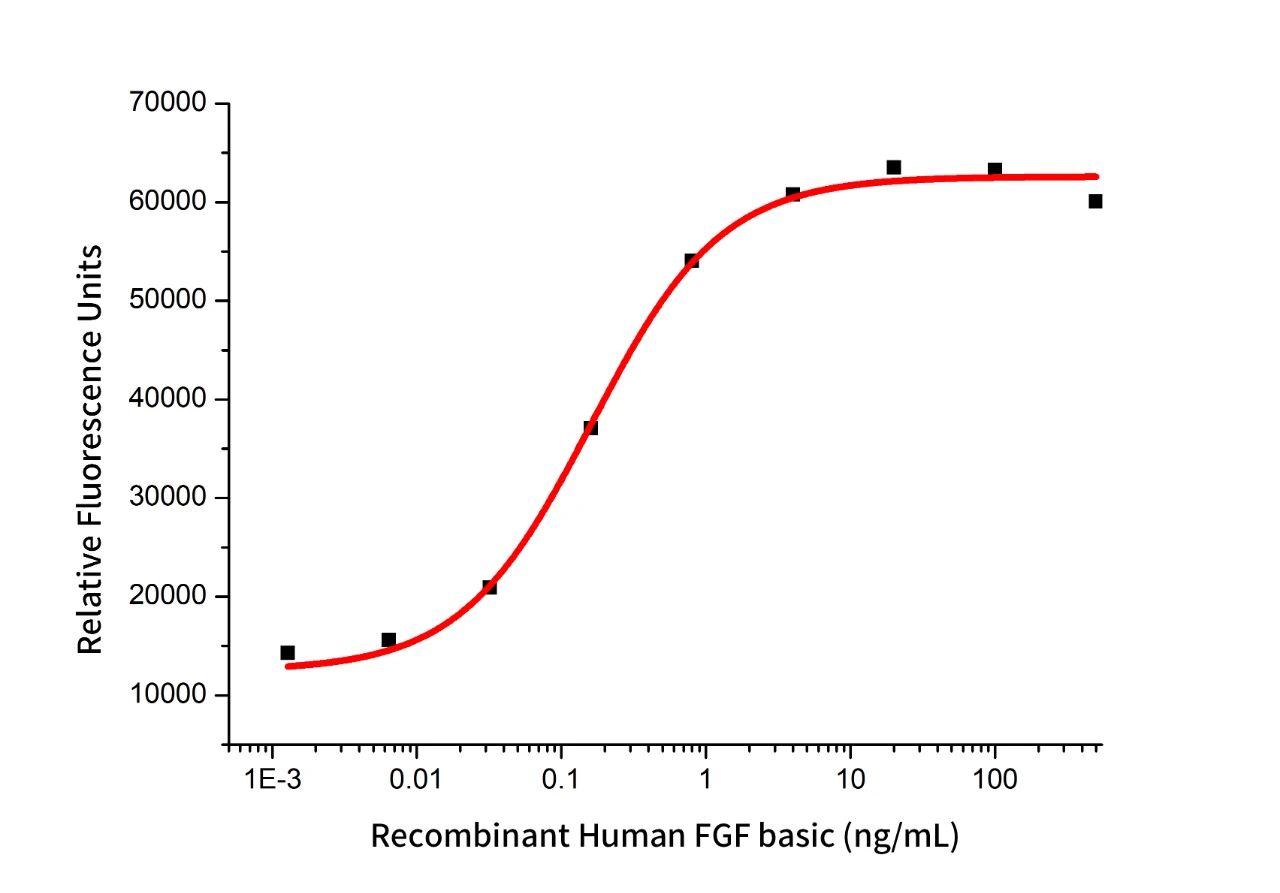
Recombinant Human bFGF (Cat.No.:GMP-C046)
Measured by its ability to induce FGF reporter activity in HEK293T human embryonic kidney cells. The ED50 for this effect is 0.16 ng/mL
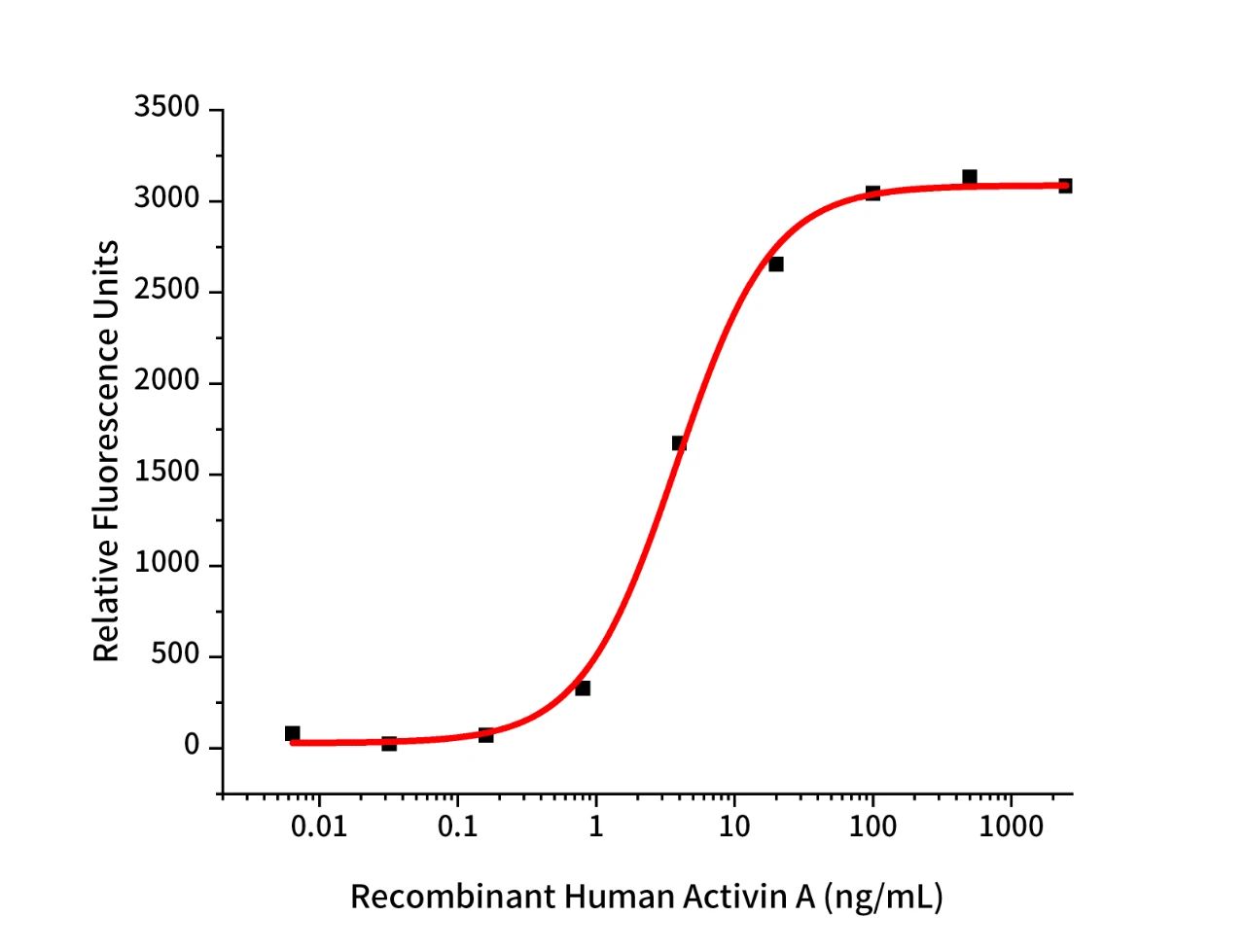
Recombinant Human Activin A (Cat.No.:GMP-C687)
Measured by its ability to induce SMAD signaling in 293-Activin A Res cells. The specific activity of recombinant human Activin A is ≥1.0 x 103 IU/mg, which is calibrated against the human Activin A Standard (NIBSC code: 91/626).
GMP级细胞因子
| 细胞类型 | 主要的细胞因子 |
| iPSC衍生的T细胞 | bFGF、BMP-4、FLT3L、IL-3、IL-7、SCF、VEGF165 |
| iPSC衍生的NK细胞 | BMP-4、FLT3L、IL-2、1L-3、IL-7、IL-15、SCF、VEGF165 |
| iPSC衍生的巨噬细胞 | bFGF、BMP-4、FLT3L、GM-CSF、IL-3、IL-7、IGF-1、M-CSF、SCF、VEGF165 |
| iPSC衍生的多巴胺能神经元/神经前体细胞 | BDNF、FGF8b、GDNF、SHH(C25Ⅱ)、TGF beta3 |
| iPSC衍生的其他神经相关细胞 | 运动神经元:bFGF、BDNF、CNTF、GDNF、IGF-1、SHH |
| 星形胶质细胞:ActivinA、BMP-4、bFGF、CNTF、EGF、IGFI、NRGlBeta | |
| 神经祖细胞NPC/NSC:bFGF、NT-3 | |
| iPSC衍生的心肌细胞 | Activin A、BMP-4、bFGF、DKKl、SCF、TGF-beta l、transferrin、VEGF165、Wnt 3a |
| iPSC衍生的胰岛细胞 | ActivinA、KGF |
高编辑效率、低脱靶以及专利授权清晰的GMP级基因编辑器
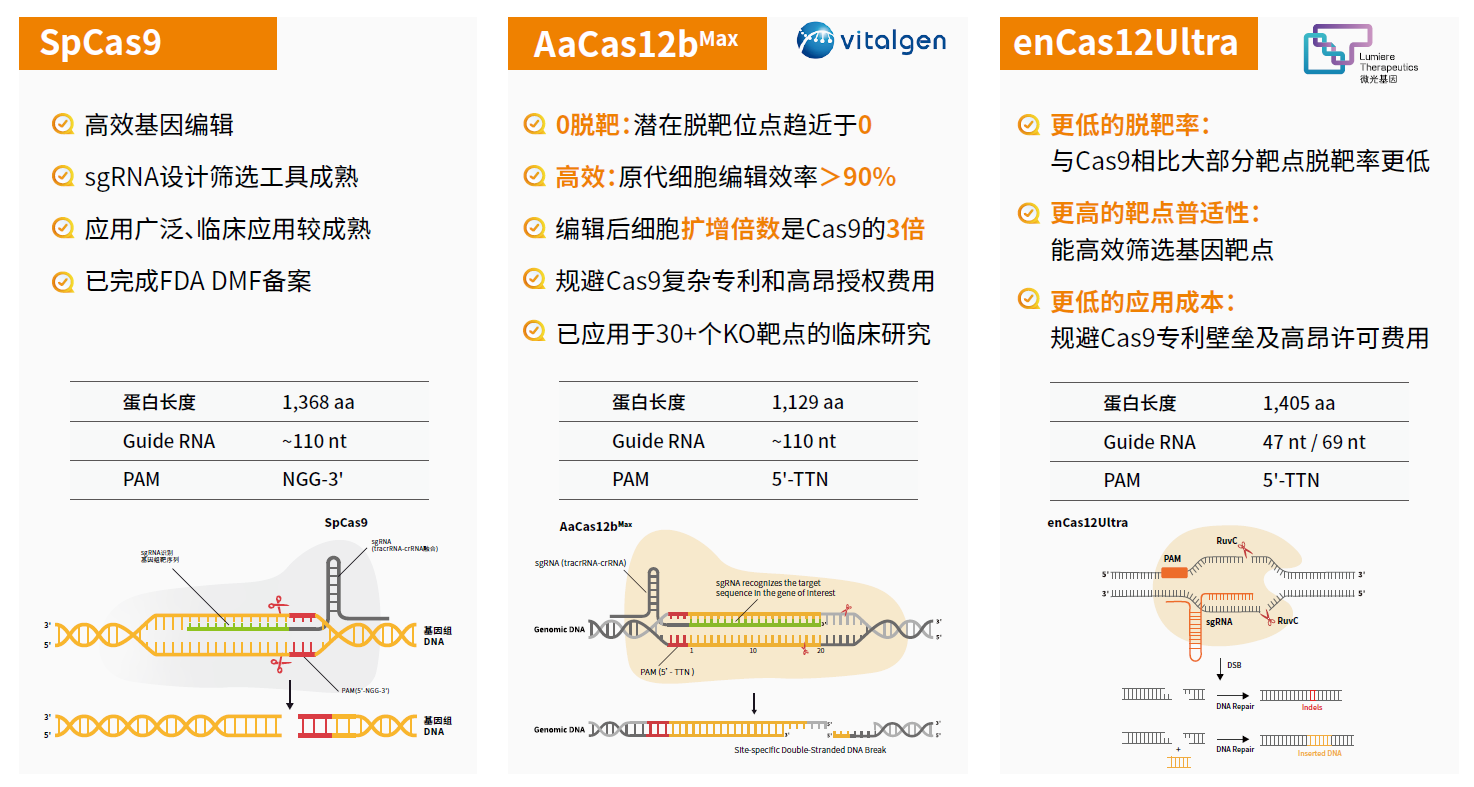
推荐产品

参考文献
[1]Takahashi, K., & Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126(4), 663-676.
[2]Delsing, L., Herland, A., Falk, A., Hicks, R., Synnergren, J., & Zetterberg, H. (2020). Models of the blood-brain barrier using iPSC-derived cells. Molecular and Cellular Neuroscience, 107, 103533.
[3]Mallapaty S. (2020). Revealed: two men in China were first to receive pioneering stem-cell treatment for heart disease. Nature, 581(7808), 249–250.
[4]Yoshida, S., Yamada, T., Sugita, S., & Sonoda, K. H. (2017). Therapeutic potential of human induced pluripotent stem cells for retinal degenerative diseases. Neural Regeneration Research, 12(4), 533-538.
[5]Soma, T., et al. (2024). Induced pluripotent stem-cell-derived corneal epithelium for transplant surgery: a single-arm, open-label, first-in-human interventional study in Japan. Lancet , 404(10466), 1929–1939.
[6]Ross, C. A., & Akimov, S. S. (2014). Human-induced pluripotent stem cells: Potential for neurodegenerative diseases. Human Molecular Genetics, 23(R1), R17-R26.
[7]Koch, P. J., Webb, S., Gugger, J. A., Salois, M. N., & Koster, M. I. (2022). Differentiation of human induced pluripotent stem cells into keratinocytes. Current Protocols, 2022. Wiley Online Library.
[8]Li, Y. C., Zhu, K., & Young, T. H. (2021). Induced pluripotent stem cells: From in vitro tissue engineering to in vivo allogeneic transplantation. Tissue Engineering and Regenerative Medicine, 18(6), 725-737.
