血管侵犯是肝细胞癌(HCC)肝内转移以及远处转移的主要途径,也是一个强有力的负面预后因素。环状 RNA(circRNA)在肿瘤发生和转移中发挥着重要作用。然而,circRNAs 在 HCC 血管侵袭发展过程中的调控功能和内在机制尚不清楚。
今年十月份,四川大学华西医院在Molecular Cancer上发表了一篇名为circPSD3 is a promising inhibitor of uPA system to inhibit vascular invasion and metastasis in hepatocellular carcinoma的文章,通过体内体外的实验证明circPSD3是uPA系统一种很有前景的抑制剂。circPSD3是HCC血管侵袭和转移的重要调节因子,可作为预后生物标志物和治疗靶点。

研 究 结 果
circPSD3是PVTT形成的潜在调节因子
为了筛选出在HCC细胞中参与到血管侵袭的circRNA,针对5个配对的PVTT和HCC组织研究人员做了相关的circRNA-seq。一共检测到13238个circRNA,通过一定的筛选标准由100个circRNA被识别出来。在PVTT组织中,有46个上调,有54个显著的下调。结果表明,PVTT组织中存在高度的异质性。
为了进一步确认circRNA参与到血管侵袭,研究人员针对19组PVTT和HCC配对的组织中选择了8个显著下调的circRNA,通过qpcr,利用不同的引物扩增了目标circRNA,结果表明只有circPSD3在HCC组织中显著下调。在circRNA-seq中也是circPSD3显著下调(fog1C)。之后通过癌和癌旁组织中circPSD3在HCC组织中明显下降(fig1D)。对于MVI组circPSD3的水平比non-MVI组低(fig1E),并且生存曲线表明,circPSD3和生存相关(figF、G)。因此,circPSD3被选为调控血管侵袭和转移的候选circRNA,并且进一步对其做了深入研究。
通过fig1H表明,circPSD3是由PSD3基因的13、14号外显子剪切形成的。为了确认环状circPSD3的性质,研究人员做了一系列的实验。首先,通过对HCC细胞的circPSD3进行接头处的桑格测序。通过对cDNA和gDNA的检测,证实了circPSD3的存在(figI、J)。最终,通过核质分离和FISH实验表明:circPSD3优先表达于细胞质中。
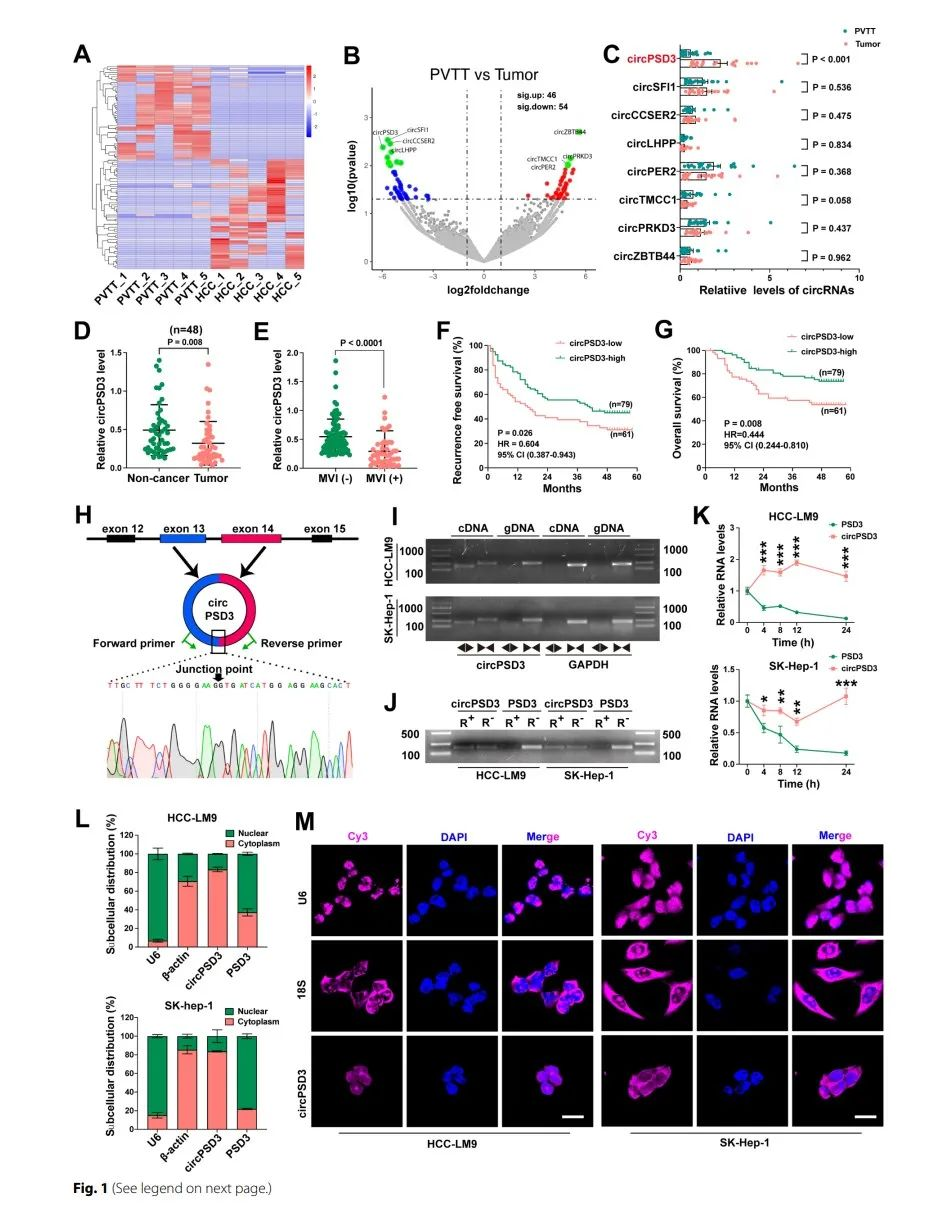
TDP43抑制了HCC中circPSD3的生物合成
很多RNA结合蛋白会调节circRNA的生物合成,通过circInteractome工具,研究人员找到了circPSD3 pre-mRNA下游内含子TDP43三个假定的结合位点(fig2A)。TDP43介导RNA代谢的多个方面。为了证实TDP43和mRNA的相互作用,设计了五对引物(fig2B)。之后,通过RIP实验,使用TDP43的抗体,结果表明TDP32只富集了引物E的目的序列,表明TDP43通过引物E形成了蛋白-RNA复合物(fig2C)。通过癌和癌旁组织的比较,在HCC组织中circPSD3显著上调,通过WB也验证了这个结果(fig2E、F)。通过Pearson相关性分析表明在PVTT组织中TDP43和circPSD3呈现负相关(fig2G)。在HCC细胞中,TDP43的减少会显著降低circPSD3的表达(fig2H-J)。这些结果都表明,TDP43会抑制circPSD3的生物合成,circPSD3可能会介导TDP43对于HCC细胞的侵袭和转移的调节作用。
circPSD3会抑制体内HCC细胞的迁移和侵袭
为了探究circPSD3在HCC形成中的作用,在这里研究人员使用了两个过表达的慢病毒以及针对circPSD3的接头处的干扰的慢病毒。通过qpcr实验表明在HCC细胞中circPSD3被成功的过表达或者敲低(fig3A-D)。在伤口愈合的实验中,对于circPSD3的过表达会显著降低HCC细胞的迁移,circPSD3的敲低会显著增强HCC细胞的迁移(fig3E、F)。在划痕实验中,circPSD3的过表达会使得HCC的迁移和侵袭消失(fig3G、H)。3D的侵袭实验模拟了HCC细胞在体内的侵袭。在SK-Hep-1细胞中,circPSD3过表达会耗竭细胞的侵袭面积以及突起数量。但是CCK8实验表明,circPSD3对细胞的增殖没有影响(fig3I、J)。

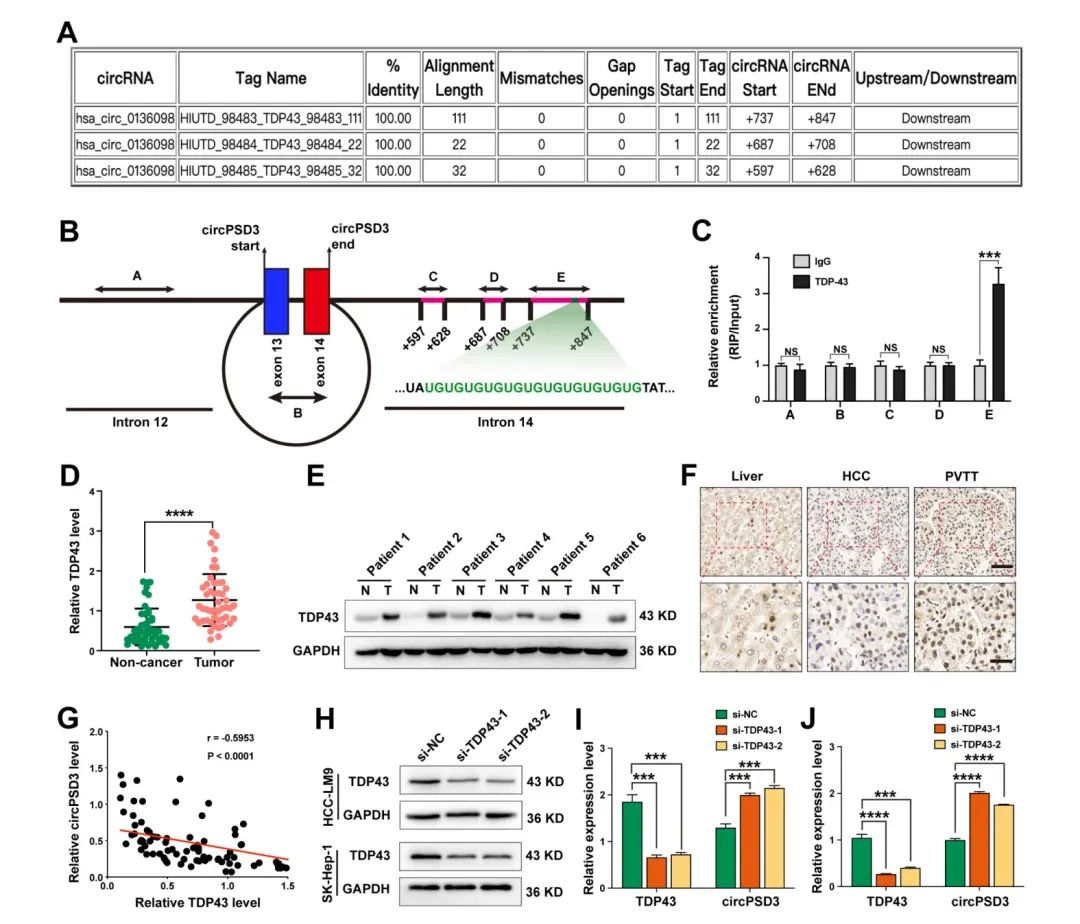
circPSD3抑制HCC细胞中远处转移、肝内转移和血管侵袭
为了进一步加深体内的研究,建立了肺转移以及肝脏原位模型。HE染色表明circPSD3的过表达显著减少了肺部转移灶的数量(fig4A)。过表达circPSD3可以显著减少肝内转移(fig4b)。为了评估circPSD3对肝内血管侵袭的影响,对肝组织进行切片和HE染色,结果表明过表达circPSD3会显著降低细胞的血管侵袭能力,相反敲除circPSD3会增加肺转移以及肝内转移(fig4C、D)。综上,这些结果表明circPSD3在抑制癌细胞和血管侵袭和转移中起着重要的作用。
circPSD3调节uPA系统
为了探究circPSD3在HCC细胞中的调节机制,研究人员在转染了过表达circPSD3d的HCC细胞上用RNA-seq进行了检测,通过不同的筛选标准,RNA-seq共鉴定出240个失调基因,其中42个基因明显上调,178个基因明显下调(fig5A)。富集分析发现这些基因和很多肿瘤相关的通路相关,包括PI3K-AKT, MAPK、ECM-受体等通路。通过qPCR验证了5个上调以及下调的基因和RNA-seq结果一致(fig5B、C)。在这些变化的基因中,SERPINB2是circPSD3过表达引起最大上调的基因。uPA系统在ECM和基底膜的降解中起着关键作用,SERPINB2 与uPA相互作用,诱导内吞uPA-uPAR复合物。为了进一步确定circPSD3在SERPINB2的表达中的调节作用,在HCC细胞中SERPINB2稳定表达同时circPSD3被敲低。这些结果表明circPSD3被删除会降低HCC细胞中SERPINB2的表达(fig5D、E)。circPSD3对于SERPINB2以及uPA系统其他组分的调节作用被WB验证(fig5F)。这些结果表明SERPINB2和它调节的uPA系统是circPSD3的下游。
为了探究Upa系统在HCC进程中的作用,SERPINB2,uPA和uPAR的mRNA通过qpcr检测,结果表明SERPINB2显著下调,uPA和uPAR显著上调(fig5G、I)。Pearson相关性表明在HCC组织中,SERPINB2的表达和circPSD3呈正相关(fig5J),加强了SERPINB2和circPSD3的相关性。免疫组化表明在非肿瘤的HCC和PVTT中SERPINB2逐渐减少,但是在uPAR中观察到一个相反的趋势(fig5K)显示了uPA促进HCC中的血管侵袭的潜在作用。体内的研究表明SERPINB2的敲除可以显著促进HCC的迁移和侵袭。WX-671,作为uPA系统的抑制剂,显著降低被circPSD3敲除所引起的细胞的迁移和侵袭(fig5L、M)。这些结果都表明,SERPINB2以及它所调节的uPA系统会抑制在HCC细胞迁移和侵袭中circPSD3的调节作用。
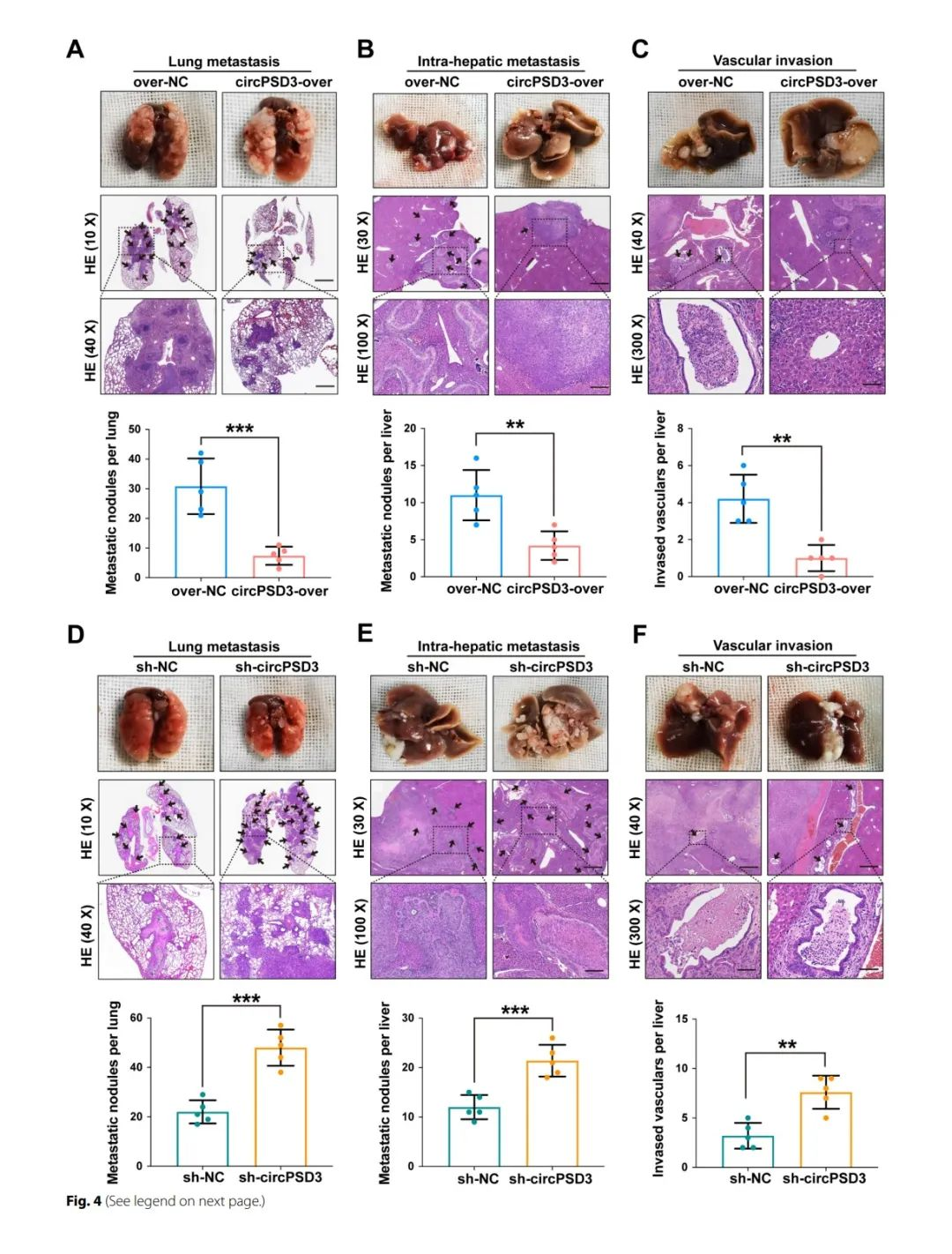
circPSD3直接和HDAC1结合
蛋白质之间的相互作用在circRNA的功能上也发挥着重要的作用。在之前的研究中,circRNA相互联系的蛋白通过RNA-pulldown通过生物素标记识别,针对circRNA的接头处。然而,由于在接头处GC的含量太高,针对circPSD3设计一个探针比较困难。所以,研究人员使用了一个MS2-标记的TRAP来识别和circPSD3结合的蛋白质。CircPSD3-MS2和GST-MS2载体一起转染进HCC-LM9细胞。circPSD3潜在结合的蛋白通过GST抗体检测(fig6A)。接下来通过LC-MS识别了145个蛋白,这些蛋白在circPSD3-MS2中富集,其中16个有超过三个独特的肽段(fig6C)。
circPSD3对于SERPINB2有调节作用,影响它的mRNA和蛋白水平。除此之外,RNA-seq结果表明circPSD3显著上调SERPINB10的mRNA水平,是SERPINB2的下游。因此,研究人员推测circPSD3和一个调节SERPINB2的蛋白结合。在circPSD3-MS2富集的蛋白中,HDAC1是组蛋白去乙酰化酶家族的成员,通过组蛋白去乙酰化参与转录抑制(fig6D)。TRAP检测表明circPSD3 和 HDAC1 之间的相互作用(图 6E)。RIP试验也表明,HCC 细胞中的 circPSD3 在HCC细胞中被 HDAC1 沉淀(图 6F)。FISH 和 IF 分析显示,内源性 circPSD3 和 HDAC1 在 HCC 细胞胞质中的共定位(图 6G)研究结果表明HDAC1敲低显著上调了在HCC细胞中SERPINB2的表达(fig6H)。因此,研究人员将HDAC1作为circPSD3结合的蛋白。随后,研究人员试图确定 HDAC1 与 circPSD3 相互作用的区域。根据 catRAPID,HDAC1 的 376-427 氨基酸序列是最有可能与 circPSD3 发生相互作用的部位。为了验证这一假设,研究人员构建了野生型和一组截短的 HDAC1 突变质粒,每个质粒都在 NH2 末端标记了三份 FLAG(3 ×FLAG)(图 6I)。这些载体在 HEK-293T 细胞中成功表达(图 6J)。RIP 实验表明,删除 HDAC1 的 376-427 氨基酸序列会取消 HDAC1 与 circPSD3 之间的相互作用。
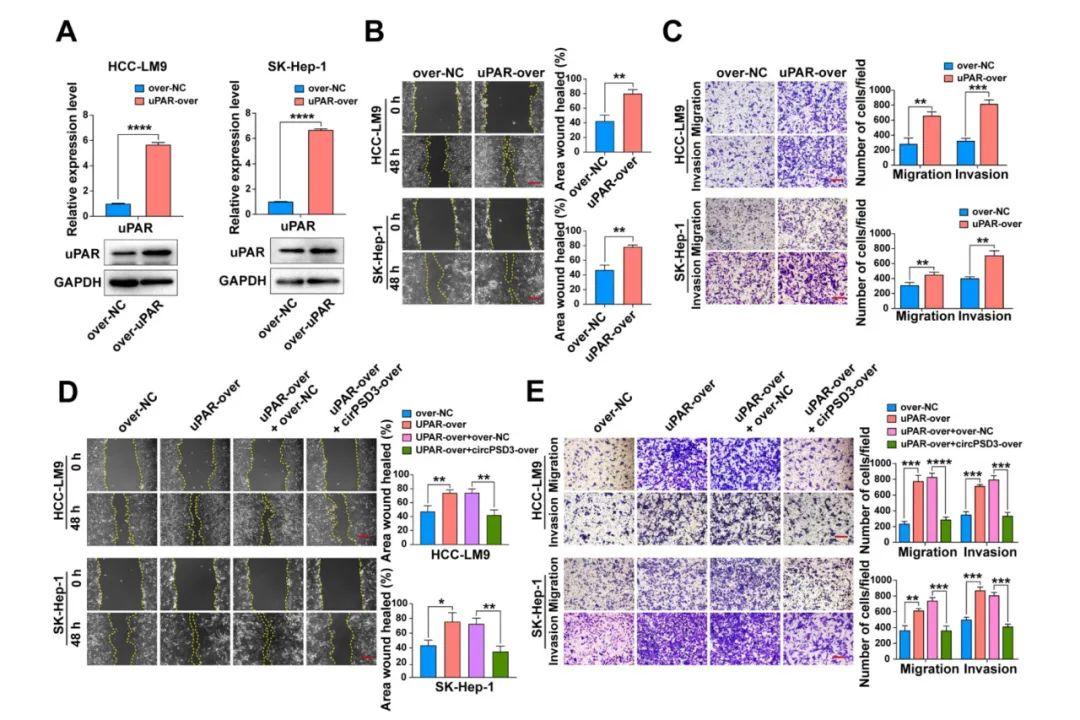
circPSD3抑制uPA系统
鉴于uPA系统在促进多种恶性肿瘤的侵袭和转移方面发挥作用,所以被作为是癌症的潜在治疗策略。研究表明,人工过表达circPSD3可能是抑制uPA系统的一种新方法。为了验证这一假设,上调uPAR的表达,以模拟活化的uPA系统。伤口愈合和 Transwell 试验表明,uPAR 过表达会明显增加 HCC 细胞的迁移和侵袭(图 7A)。这种效应被circPSD3的过表达所消除(图 7D、E)。这些结果在肺转移和肝脏原位植入和肝脏正位植入模型进一步证实。在这些模型中,circPSD3的共表达明显减轻了肺转移病灶和肝内转移结节(图 7F、G)。然而体外合成的 circPSD3 对肿瘤血管侵袭和转移的抑制作用对 HCC 血管侵袭和转移的抑制作用还需要进一步研究。
讨论:
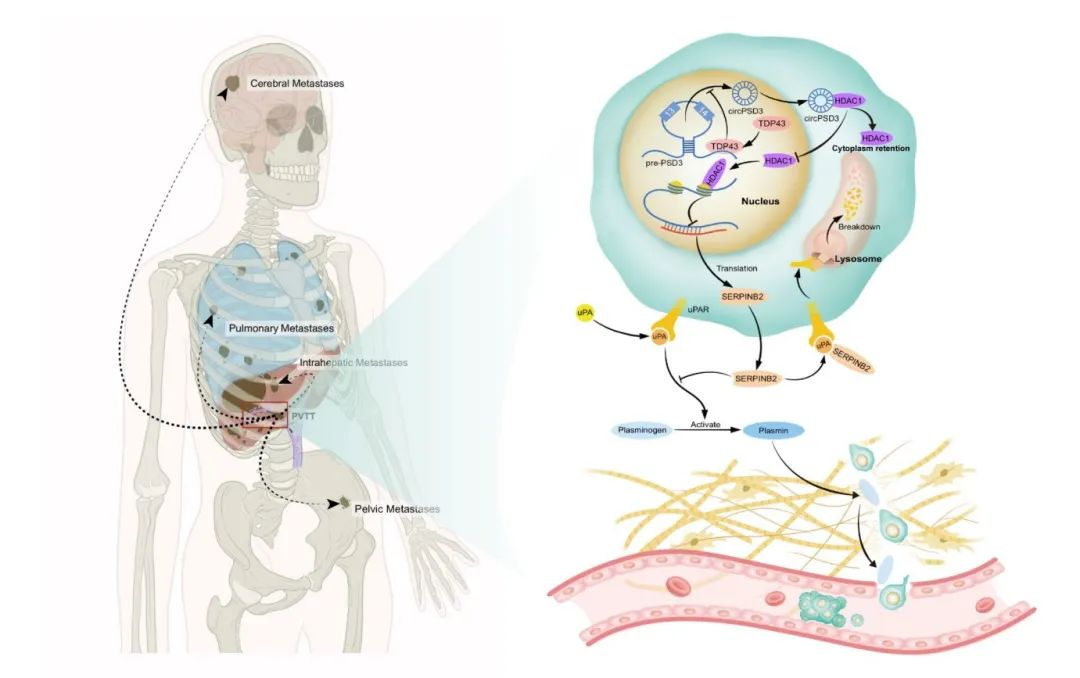
circPSD3 是一种参与侵袭和转移的 circRNA转移。肿瘤组织中 circPSD3 的减少预示着部分肝切除术后的HCC患者预后不佳。TDP43有助于circPSD3的生物生成。从机制上讲,circPSD3与HDAC1 相互作用,将 HDAC1 封闭在细胞质中,从而释放 HDAC1 的转录抑制作用。HDAC1 对 SERPINB2 的转录抑制作用。升高的 SERPINB2 会抑制uPA系统,并介导的抑制作用(图 8)。
本研究中,使用了吉凯生产的过表达慢病毒过表达circPSD3和uPAR

参考文献:
Liangliang Xu1, et al., circPSD3 is a promising inhibitor of uPA system to inhibit vascular invasion and metastasis in hepatocellular carcinoma. Molecular Cancer, 2023.Oct 26;22(1):174.
